Salah satu penerapan reaksi netralisasi adalah titrasi. Titrasi merupakan prosedur yang bertujuan untuk menentukan konsentrasi larutan asam atau basa. Titrasi yang mengacu pda jumlah volume larutan dikenal dengan istilah titrasi volumetrik. Titrasi yang melibatkan reaksi antara asam dengan basa dikenal dengan istilah titrasi asam-basa atau asidi alkalimetri. Secara teknis, titrasi dilakukan dengan cara mereaksikan sedikit demi sedikit atau tetes demi tetes larutan yang konsentrasinya telah diketahui (titran) melalui buret ke dalam larutan yang konsentrasinya ingin dicari (titrat) dengan volume tertentu yang terletak dalam labu erlenmeyer sampai keduanya tepat habis bereaksi, ditandai dengan berubahnya warna indikator.
Mengenal Macam-Macam Kurva Titrasi Asam Basa
Titrasi asam kuat dengan basa kuat
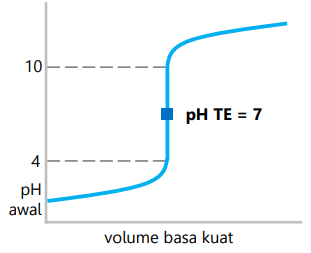
- Zat pentiter adalah basa kuat.
- Daerah perubahan pH drastis 4 – 10.
- pH titik ekuivalen 7.
- Indikator yang dapat digunakan adalah metil merah, bromtimol biru, dan fenolftalein (lebih tajam).
- Contoh: HCl dengan NaOH.
Titrasi basa kuat dengan asam kuat
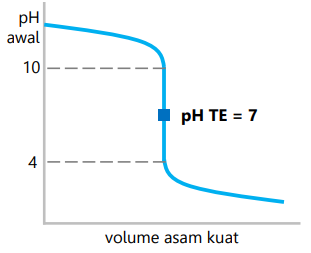
- Zat pentiter adalah asam kuat.
- Daerah perubahan pH drastis 4 – 10.
- pH titik ekuivalen 7.
- Indikator yang dapat digunakan adalah metil merah, bromtimol biru, dan fenolftalein (lebih tajam).
- Contoh: NaOH dengan HCl.
Titrasi asam kuat dengan basa lemah

- Zat pentiter adalah basa lemah.
- Daerah perubahan pH drastis 4 – 7.
- pH titik ekuivalen 5 – 6.
- Indikator yang dapat digunakan adalah metil merah.
- Contoh: HCl dengan NH4OH.
Titrasi basa lemah dengan asam kuat

- Zat pentiter adalah asam kuat.
- Daerah perubahan pH drastis 4 – 7.
- pH titik ekuivalen 5 – 6.
- Indikator yang dapat digunakan adalah metil merah.
- Contoh: NH4OH dengan HCl.
Titrasi basa kuat dengan asam lemah

- Daerah perubahan pH drastis 7 – 10.
- pH titik ekuivalen 8 – 9.
- Indikator yang dapat digunakan adalah fenolftalein.
- Contoh: NaOH dengan CH3COOH.
Titrasi asam lemah dengan basa kuat
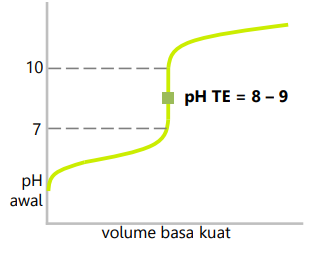
- Zat pentiter adalah basa kuat.
- Daerah perubahan pH drastis 7 – 10.
- pH titik ekuivalen 8 – 9.
- Indikator yang dapat digunakan adalah fenolftalein.
- Contoh: CH3COOH dengan NaOH.
Titrasi asam lemah menggunakan basa lemah dan sebaliknya tidak dilakukan karena:
1. Perubahan drastis pH terjadi sangat singkat.2. Tidak ada indikator yang cukup teliti untuk mengamati perubahan.
3. Reaksi berlangsung lambat dan tidak tuntas.
Rumus Titrasi Asam Basa
Rumus titrasi asam basa yang digunakan untuk menentukan konsentrasi asam/basa adalah sebagai berikut:


Tidak ada komentar:
Posting Komentar