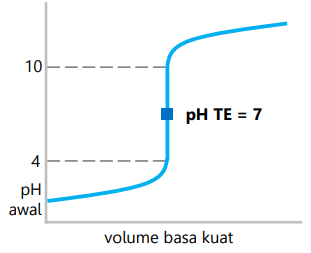
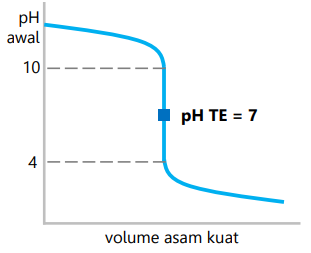
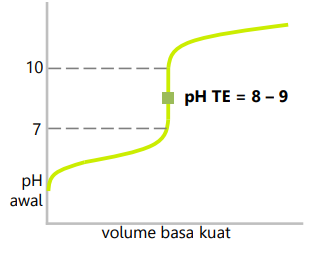
Sistem koloid dapat dibuat secara langsung dengan mendispersikan suatu zat ke dalam medium pendispersi. Selain itu, dapat dilakukan dengan mengubah suspensi menjadi koloid atau dengan mudah mengubah larutan menjadi koloid. Jika ditinjau dari perubahan ukuran partikel zat terdispersi, cara pembuatan koloid dapat dibedakan menjadi dua cara yaitu dengan cara dispersi dan cara kondensasi.
Dispersi
Dispersi adalah proses pembuatan yang berasal dari partikel yang lebih kasar dari koloid. Pembuatan dengan cara dispersi terdiri dari tiga jenis, yaitu mekanik, busur bredig, dan peptisasi.
- Pada cara mekanik, sistem ini dibuat dengan cara penggerusan dan penggilingan. Bisa juga dilakukan lewat pengadukan dan pengocokan. Cara ini umum dilakukan dalam pembuatan sol belerang.
- Metode busur bredig dilakukan dengan meletakkan logam yang akan dibuat sistem heterogen ini pada kedua ujung elektroda. Elektroda tersebut kemudian diberi arus listrik yang cukup kuat sehingga terjadi loncatan bunga api listrik. Panas kuat yang dihasilkan oleh percikan listrik menguapkan logam yang akan mengembun membentuk partikel ukuran koloid. Metode ini biasanya digunakan untuk membuat sol koloid dari logam seperti emas, platinum, dan lain-lain.
- Pembuatan dengan cara dispersi yang terakhir adalah peptisasi. Peptisasi adalah proses mengubah endapan menjadi sol koloid dengan mengocoknya menggunakan medium pendispersi dengan sedikit elektrolit. Selama peptisasi, endapan mengadsorpsi salah satu ion elektrolit di permukaannya. Ini menghasilkan pengembangan muatan positif atau negatif pada endapan yang akhirnya memecah menjadi partikel yang lebih kecil dari ukuran koloid. Contohnya adalah pembuatan sol belerang dari endapan nikel sulfida dengan cara mengalirkan gas asam sulfida.
Kondensasi
Selain dispersi, ada juga yang disebut kondensasi. Pada kondensasi, partikel larutan sejati (molekul atau ion) bergabung menjadi partikel koloid. Cara ini dapat dilakukan dengan reaksi-reaksi kimia, seperti reaksi redoks, hidrolisis, dan dekomposisi rangkap atau pergantian pelarut.
Reaksi redoks biasa digunakan dalam pembuatan sol belerang dan sol emas. Sementara itu, reaksi hidrolisis digunakan dalam pembuatan sol Fe(OH)3. Dekomposisi rangkap atau pergantian pelarut dilakukan dalam pembuatan koloid As2S3.